燃料電池って?
最近、クリーンな新エネルギーとして、期待が高まっているモノの中に燃料電池があります。省エネ効果も高く、環境にもやさしいということで評判が高いため、次世代のエネルギーとして実用化が進んでいます。この燃料電池の原理は約200年も前から発見されていましたが、製作上の技術や材料などの問題が多かったため、100年以上もの間人々の目に触れることはありませんでした。しかし、現在、その多くの問題が解決し、実用化の一歩手前まできています。この水素と酸素を使って電気を取り出すことができる燃料電池のしくみをご紹介します。
燃料電池のしくみ
▲燃料電池のしくみ |
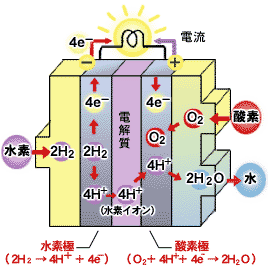
燃料電池の基本的なしくみは、電解質をはさんだ一対の電極と、それらを結ぶ電線(外部回路)からなります。一方の電極に水素を供給し、もう一方には酸素を供給することによって発電します。
水素が供給される極では、電極の触媒作用によって、電子を放出して水素イオンとなり、電解質(※)を通って酸素が供給される極へ移動します。そして、この時放出された電子は、外部回路を通ります。
酸素が供給される極では、電解質を通ってきた水素イオンと外部回路を通ってきた電子、そしてそこに供給されている酸素が結合して水の分子になります。(図)
この時、電線(外部回路)に生じる電子の流れが直流電流として取り出されます。なお、この反応にともない水と熱が排出されます。
水素が電子を放出してイオン化したり、酸素と結合して水となる反応が起こるのは、それぞれの気体と電極と電解質の三つの相が接する場所(三相界面)だけです。この三相が接する場所の面積で、生み出す電流の大きさが決まります。
供給された水素分子は、電極で白金などの触媒作用を受けて、水素イオンと電子に分かれます。遊離した電子は−極に集まり、水素イオンは電解質を通って+極に移動します。
(※)電解質について
水を電気分解するためには、電解質が必要となります。これは、純水の場合だと電気が流れず、電気分解が起こらないからです。そのため、主に酸(硫酸)やアルカリ(水酸化ナトリウム)の水溶液を使います。また、燃料電池にも同じように電解質が必要です。この場合、電解質は、イオンを通す性質(イオン伝導性)と、電子を通さない性質(電子非伝導性)を兼ね備えています。
本当にクリーンなの?
燃料電池の発電のしくみのみをみると水だけが排出されるため、ほぼ無公害だといえます。しかし、供給される水素についてはちょっと勝手が違います。水素は地球上において海水、陸水(氷河、湖沼)、炭化水素、動植物の細胞水など、ほとんどすべての物質の構成要素になっているため、どこにでもあります。しかし、単体ではほとんど存在せず、水、炭化水素、金属水素化合物、炭水化物の形で「化合物」として存在しています。そのため、燃料電池で使用するためには、これらの化合物から何らかの方法で水素を単体で取り出す必要があります。ただし、その製造段階において、少量の二酸化炭素を排出してしまうことがあります。でも、自動車の排気ガスなどとくらべると格段に少ないため、クリーンなエネルギーとして注目されています。
燃料電池を使ってみよう!

▲燃料電池模型自動車 |
博物館の科学実験教室「電池の秘密?〜太陽電池と燃料電池〜」の時間に燃料電池で模型自動車(写真)を走らせてみました。この時使用した燃料電池は、固体高分子型という電解質にイオン交換膜を用いたもので、水素を供給するだけ(酸素は空気中から供給します)で発電するものでした。
参加した子どもたちは、電池を使わず、水素だけで動き出した模型自動車にびっくりしていました。でも、実際に人が乗れる燃料電池自動車が登場するのもあとわずかです。

|

